Faktor nekroze tumora-alfa
| edit |
Faktor nekroze tumora-alfa (TNF-alfa, TNF, kaheksin (cachexin) ili kahektin (cachectin), je citokin koji učestvuje u sistemskoj inflamaciji. On je član grupe citokina koji stimulišu akutnu fazu reakcije.
Primarna TNF uloga je regulacija imunskih ćelija. TNF može da indukuje apoptoznu ćelijsku smrt, inflamaciju, i da inhibira tumorigenezu i viralnu replikaciju. Disregulacija TNF produkcije je bila implicirana u niz ljudskih bolesti, kao i rak.[1] Rekombinantni TNF se koristi kao imunostimulant pod nazivom (INN) tasonermin.[2]
Teorija antitumorog responsa imunskog sistema in vivo je bila oformljena pre više od 100 godine od strane lekara Wilijam B. Koli. 1968 godine je Dr. Gale A Granger sa Kalifornijskog univerziteta u Irvinama je otkrio citotoksični faktor koji proizvode limfociti i nazvao ga je limfotoksin (LT).[3] Zaslugu za ovo otkriće takođe ima dr. Nansi H. Ruddle sa Jelskog univerziteta, koja je istovremeno nezavisno objavila tu istu aktivnost.[4] Naknadno 1975 godine dr. Lloyd J. Old iz Memorijalnog Sloan-Kettering centar za rak, Njujork, je objavio još jedan citotoksični faktor koji proizvode makrofage, i nazvao ga je faktor nekroze tumora (TNF).[5] Oba faktora su bila opisana na osnovu njihove sposobnosti da ubiju mišje fibrosarkom L-929 ćelije.
Kad su LT i TNF cDNK sekvence klonirane 1984 godine,[6] ispostavilo se da su veoma slične. Putem TNF vezivanja za receptor, i njegovim istiskivanjem LT-om je potvrđena funkcionalna homologija između ova dva faktora. Sekvenciona i funkcionalna homologija TNF i LT je dovela do preimenovanja TNF kao TNFα i LT kao TNFβ. 1985 godine, Bruc A. Beutler i Antoni Cerami su otkrili da je hormone koji indukuje kaheksiju, i koji je prethodno bio nazvan kahektin, zapravo TNF.[7] Ovi istraživači su potom utvrdili da je TNF ključni medijator septičkog šoka u responsu na infekciju.[8] Subsekventno je bilo prihvaćeno da je TNF prototipski član velike citokinske familije, TNF familije.
Ljudski TNF gen (TNFA) je bio kloniran 1985.[9] On se nalazi na hromozomu 6p21.3, sadrži oko 3 kb i ima 4 eksona. Zadnji ekson kodira za više od 80% izlučenog proteina.[10] TNF-alfa 3' UTR sadrži AU-bogat element (ARE).
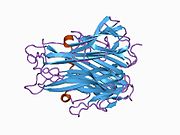
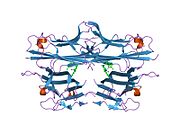
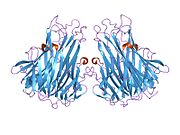
TNF se prvenstveno proizvodi kao 212-aminokiselina-dugačak tip II transmembranski protein koji formira stabilne homotrimere.[11][12] Iz ove forme integrisane u membranu, rastvorni homotrimerni citokin (sTNF) se formira putem proteolitičkog odsecanja metaloproteazama TNF-alfa konvertujućim enzimima (TACE, koji se takođe zove ADAM17).[13] Rastvorni 51 kDa trimerični sTNF je sklon disocijaciji u koncentracijama ispod nanomolarnih, tako da gubi svoju bioaktivnost.
17-kDa TNF protomeri (185-aminokiselina-dugi) se sastoje od dve antiparalelne β-naborane ravni sa antiparalelnim β-lancima. Oni formiraju 'Švajcarska rolna' β-strukturu, koja je tipična za TNF familiju, a koja je takođe prisutna kod viralnih kapsidnih proteina.

Dva receptora, TNF-R1 (TNF receptor tip 1; CD120a; p55/60) i TNF-R2 (TNF receptor tip 2; CD120b; p75/80), se mogu vezati za TNF. TNF-R1 je izražen u većini tkiva, i može biti potpuno aktiviran sa obe forme proteina, membranski-vezanom i rastvornom trimernom formom TNF. TNF-R2 se može naći samo u ćelijama imunskog sistema, i odgovara na formu TNF-trimera koja je vezana za membranu. Najveći deo dostupnih informacija o TNF signalizaciji izveden iz TNF-R1. Uloga TNF-R2 receptora nije dovoljno ispitana.
Nakon kontakta sa njihovim ligandom, TNF receptori takođe formiraju trimere, njihovi izbočeni delovi popunjavaju žlebove između TNF monomera. Vezivanje uzrokuje konformacionu promenu receptora, čime dolazi do disocijacije inhibitornog proteina SODD sa intracelularnog domena. Ova disocijacija omogućava adapterskom proteinu TRADD da se veže za domen uginuća, a ovim stvara mogućnost za dodatno proteinsko vezivanje. Nakon TRADD vezivanja, tri signalna puta mogu biti inicirana.[14][15]
- Aktivacija NF-κB: TRADD regrutuje TRAF2 i RIP. TRAF22 zatim regrutuje multikomponentni protein kinazu IKK, što omogućava serin-treonin kinazi RIP da ga aktivira. Inhibitorni protein, IκBα, koji se normalno vezuje za NF-κB i inhibira njegovu translokaciju, se fosforiliše IKK kinazom i naknadno se degradira, čime se oslobađa NF-κB. NF-κB je heterodimerni transkripcioni faktor koji se translocira u nukleus i posreduje transkripciju velikog broja proteina koji imaju udela u ćelijskom preživljavanju i proliferaciji, inflamatornom odgovoru, kao i antiapoptoznih faktora.
- Aktivacija MAPK puta: Od tri glavne MAPK kaskade, TNF indukuje jaku aktivaciju stres-vezane JNK grupe, evocira umereni p38-MAPK odgovor, i odgovoran je za minimalnu aktivaciju klasičnih ERK proteina. TRAF2 aktivira JNK-indukujuće nizvodne kinaze MEKK1 i ASK1 (bilo direktno ili kroz GCK i Trx, respektivno), i te dve kinaze fosforilizuju MKK7, koja onda aktivira JNK. JNK se translocira u nukleus i aktivira transkripcione faktore kao što su c-Jun i ATF2. JNK signalni put učestvuje u ćelijskoj diferencijaciji, proliferaciji, i generalno je proapoptozan.
- Indukcija signala smrti: Poput svih domen-smrti sadržavajućih članova TNFR superfamilije, TNF-R1 učestvuje u signalizaciji ćelijske smrti.[16] Međutim, TNF-indukovana ćelijska smrt igra samo manju ulogu u poređenju sa njegovim sveobuhvatnim funkcijama u inflamatornom procesu. Njegov smrt-indukujući kapacitet je slab u poređenju sa drugim članovima familije (kao što je Fas), i često je prikriven NF-κB antiapoptoznim efektima. Ipak, TRADD vezuje FADD, koji onda regrutuje cistein proteazu kaspazu-8. Visoka koncentracija kapsaze-8 indukuje njegovu auto-proteolitičku aktivaciju i naknadno cepanje efektorskih kaspaza, što dovodi do ćelijske apoptoze.
Za faktor nekroze tumora-alfa je bilo pokazano da interaguje sa TNFRSF1A.[17][18]
- Limfotoksin (Faktor nekroze tumora-beta)
- ↑ Locksley RM, Killeen N, Lenardo MJ (2001). „The TNF and TNF receptor superfamilies: integrating mammalian biology”. Cell 104 (4): 487–501. DOI:10.1016/S0092-8674(01)00237-9. PMID 11239407.
- ↑ Mire-Sluis, Anthony R.; Thorpe, Robin, ur. (1998). Cytokines (Handbook of Immunopharmacology). Boston: Academic Press. ISBN 0-12-498340-5.
- ↑ Kolb WP, Granger GA (1968). „Lymphocyte in vitro cytotoxicity: characterization of human lymphotoxin”. Proc. Natl. Acad. Sci. U.S.A. 61 (4): 1250–5. DOI:10.1073/pnas.61.4.1250. PMC 225248. PMID 5249808.
- ↑ Ruddle NH, Waksman BH (December 1968). „Cytotoxicity mediated by soluble antigen and lymphocytes in delayed hypersensitivity. 3. Analysis of mechanism”. J. Exp. Med. 128 (6): 1267–79. DOI:10.1084/jem.128.6.1267. PMC 2138574. PMID 5693925.
- ↑ Carswell EA, Old LJ, Kassel RL, Green S, Fiore N, Williamson B (1975). „An endotoxin-induced serum factor that causes necrosis of tumors”. Proc. Natl. Acad. Sci. U.S.A. 72 (9): 3666–70. DOI:10.1073/pnas.72.9.3666. PMC 433057. PMID 1103152.
- ↑ Pennica D, Nedwin GE, Hayflick JS, Seeburg PH, Derynck R, Palladino MA, Kohr WJ, Aggarwal BB, Goeddel DV (1984). „Human tumour necrosis factor: precursor structure, expression and homology to lymphotoxin”. Nature 312 (5996): 724–9. DOI:10.1038/312724a0. PMID 6392892.
- ↑ Beutler B, Greenwald D, Hulmes JD, Chang M, Pan YC, Mathison J, Ulevitch R, Cerami A (1985). „Identity of tumour necrosis factor and the macrophage-secreted factor cachectin”. Nature 316 (6028): 552–4. DOI:10.1038/316552a0. PMID 2993897.
- ↑ Beutler B, Milsark IW, Cerami AC (August 1985). „Passive immunization against cachectin/tumor necrosis factor protects mice from lethal effect of endotoxin”. Science (journal) 229 (4716): 869–71. DOI:10.1126/science.3895437. PMID 3895437.
- ↑ Old LJ (1985). „Tumor necrosis factor (TNF)”. Science 230 (4726): 630–2. DOI:10.1126/science.2413547. PMID 2413547.
- ↑ Nedwin GE, Naylor SL, Sakaguchi AY, Smith D, Jarrett-Nedwin J, Pennica D, Goeddel DV, Gray PW (1985). „Human lymphotoxin and tumor necrosis factor genes: structure, homology and chromosomal localization”. Nucleic Acids Res. 13 (17): 6361–73. DOI:10.1093/nar/13.17.6361. PMC 321958. PMID 2995927.[mrtav link]
- ↑ Kriegler M, Perez C, DeFay K, Albert I, Lu SD (1988). „A novel form of TNF/cachectin is a cell surface cytotoxic transmembrane protein: ramifications for the complex physiology of TNF”. Cell 53 (1): 45–53. DOI:10.1016/0092-8674(88)90486-2. PMID 3349526.
- ↑ Tang P, Hung M-C, Klostergaard J (1996). „Human pro-tumor necrosis factor is a homotrimer”. Biochemistry 35 (25): 8216–25. DOI:10.1021/bi952182t. PMID 8679576.
- ↑ Black RA, Rauch CT, Kozlosky CJ, Peschon JJ, Slack JL, Wolfson MF, Castner BJ, Stocking KL, Reddy P, Srinivasan S, Nelson N, Boiani N, Schooley KA, Gerhart M, Davis R, Fitzner JN, Johnson RS, Paxton RJ, March CJ, Cerretti DP (1997). „A metalloproteinase disintegrin that releases tumour-necrosis factor-alpha from cells”. Nature 385 (6618): 729–33. DOI:10.1038/385729a0. PMID 9034190.
- ↑ Wajant H, Pfizenmaier K, Scheurich P (2003). „Tumor necrosis factor signaling”. Cell Death Differ. 10 (1): 45–65. DOI:10.1038/sj.cdd.4401189. PMID 12655295.
- ↑ Chen G, Goeddel DV (2002). „TNF-R1 signaling: a beautiful pathway”. Science 296 (5573): 1634–5. DOI:10.1126/science.1071924. PMID 12040173.
- ↑ Gaur U, Aggarwal BB (2003). „Regulation of proliferation, survival and apoptosis by members of the TNF superfamily”. Biochem. Pharmacol. 66 (8): 1403–8. DOI:10.1016/S0006-2952(03)00490-8. PMID 14555214.
- ↑ Bouwmeester, Tewis; Bauch Angela, Ruffner Heinz, Angrand Pierre-Olivier, Bergamini Giovanna, Croughton Karen, Cruciat Cristina, Eberhard Dirk, Gagneur Julien, Ghidelli Sonja, Hopf Carsten, Huhse Bettina, Mangano Raffaella, Michon Anne-Marie, Schirle Markus, Schlegl Judith, Schwab Markus, Stein Martin A, Bauer Andreas, Casari Georg, Drewes Gerard, Gavin Anne-Claude, Jackson David B, Joberty Gerard, Neubauer Gitte, Rick Jens, Kuster Bernhard, Superti-Furga Giulio (February 2004). „A physical and functional map of the human TNF-alpha/NF-kappa B signal transduction pathway”. Nat. Cell Biol. (England) 6 (2): 97–105. DOI:10.1038/ncb1086. ISSN 1465-7392. PMID 14743216.
- ↑ Micheau, Olivier; Tschopp Jürg (July 2003). „Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes”. Cell (United States) 114 (2): 181–90. DOI:10.1016/S0092-8674(03)00521-X. ISSN 0092-8674. PMID 12887920.