Fibrose pulmonar idiopática
| Fibrose pulmonar idiopática | |
|---|---|
| A Figura A mostra a localização dos pulmões e das vias aéreas no corpo. A imagem inserida mostra uma visão detalhada das vias aéreas e dos sacos aéreos do pulmão em seção transversal. A Figura B mostra a fibrose (cicatrização) nos pulmões. A imagem inserida mostra uma visão detalhada da fibrose e como ela danifica as vias aéreas e os sacos aéreos.[1] | |
| Especialidade | pneumologia |
| Sintomas | Dispneia e tosse seca[1] |
| Complicações | Hipertensão pulmonar, insuficiência cardíaca, pneumonia e embolia pulmonar[1] |
| Causas | Desconhecidas[2] |
| Fatores de risco | Tabagismo, certas viroses, histórico familiar[1] |
| Método de diagnóstico | Tomografia computadorizada e biópsia de pulmão[3] |
| Condições semelhantes | Sarcoidose, doença pulmonar intersticial e pneumonite de hipersensibilidade[4] |
| Tratamento | Reabilitação pulmonar, oxigenoterapia e transplante de pulmão[1] |
| Medicação | Pirfenidona e nintendanib[2] |
| Prognóstico | Esperança de vida: ~ 4 anos |
| Frequência | 12 a cada 100.000 pessoas por ano |
| Classificação e recursos externos | |
| CID-10 | J84.1 |
| CID-9 | 516.31 |
| CID-11 | 1074069640 |
| OMIM | 178500 |
| DiseasesDB | 4815 |
| MedlinePlus | 000069 |
| eMedicine | 363273, 301226 |
| MeSH | D054990 |
A fibrose pulmonar idiopática (FPI), ou (anteriormente[5]) alveolite fibrosante, é uma doença rara e progressiva do sistema respiratório, caracterizada pelo espessamento e enrijecimento do tecido pulmonar, associado à formação de tecido cicatricial. É um tipo de doença fibrose pulmonar crônica caracterizada por um declínio progressivo e irreversível da função pulmonar.[3][4] O tecido dos pulmões torna-se espesso e rígido, o que afeta o tecido que circunda os sacos aéreos nos pulmões.[6] Os sintomas geralmente incluem o início gradual de falta de ar e tosse seca.[1] Outras alterações podem incluir sensação de cansaço e unhas dos pés e das mãos anormalmente grandes e em formato de cúpula (baqueteameto dos digital).[1] As complicações podem incluir hipertensão pulmonar, insuficiência cardíaca, pneumonia ou embolia pulmonar.[1]
A causa é desconhecida, daí o termo idiopático.[2] Os fatores de risco incluem o tabagismo, a doença de refluxo gastroesofágico (DRGE), certas viroses e predisposição genética.[1] O mecanismo subjacente envolve a formação de cicatrizes nos pulmões (fibrose).[1] O diagnóstico requer a exclusão de outras possíveis causas.[3] Pode ser apoiado por uma tomografia computadorizada de alta resolução (TCAR) ou biópsia pulmonar que mostre pneumonia intersticial usual (PIU).[3] É um tipo de doença pulmonar intersticial (DPI).[3]
As pessoas geralmente se beneficiam da reabilitação pulmonar e do oxigênio suplementar.[1] Certos medicamentos, como pirfenidona ou nintedanibe, podem retardar a progressão da doença.[2] O transplante de pulmão também pode ser uma opção.[1]
Cerca de 5 milhões de pessoas são afetadas em todo o mundo.[7] A doença ocorre recentemente em cerca de 12 a cada 100.000 pessoas por ano.[4] As pessoas com 60 e 70 anos são as mais comumente afetadas.[4] Os homens são afetados com mais frequência do que as mulheres.[4] A expectativa média de vida após o diagnóstico é de cerca de quatro anos.[1] Diretrizes internacionais atualizadas foram publicadas em 2022, com alguma simplificação no diagnóstico e a remoção de antiácidos como uma possível terapia adjuvante.[8]
Sinais e sintomas
[editar | editar código-fonte]
 |
|
| Problemas para escutar este arquivo? Veja a ajuda. | |
Em muitas pessoas, os sintomas estão presentes por um tempo considerável antes do diagnóstico.[7] As características clínicas mais comuns da FPI incluem o seguinte:[3][9][10]
- Idade acima de 50 anos.
- Tosse seca e não produtiva ao esforço.
- Dispneia de esforço progressiva (falta de ar ao se exercitar).
- Crepitações bibasilares secas e inspiratórias do tipo "velcro" na ausculta (um som crepitante nos pulmões durante a inalação, semelhante ao velcro sendo rasgado lentamente, ouvido com um estetoscópio).[3][11][12]
- Baqueteamento digital, uma desfiguração das pontas dos dedos das mãos ou dos pés (veja a imagem).
- Resultados anormais dos testes de função pulmonar, com evidência de restrição e troca de gases prejudicada.
Algumas dessas características são devidas à hipoxemia crônica (deficiência de oxigênio no sangue), não são específicas da FPI e podem ocorrer em outros distúrbios pulmonares. A FPI deve ser considerada em todos os pacientes com dispneia de esforço crônica inexplicável que apresentem tosse, crepitações bibasilares inspiratórias ou baqueteamento dos dedos.[3]
A avaliação das crepitações em "velcro" na ausculta pulmonar é uma maneira prática de melhorar o diagnóstico precoce da FPI. As crepitações finas são facilmente reconhecidas pelos médicos e são características da FPI.[13]
Se as crepitações finas bilaterais estiverem presentes durante todo o tempo inspiratório e persistirem após várias respirações profundas, e se permanecerem presentes em várias ocasiões com várias semanas de intervalo em um indivíduo com idade maior ou igual a 60 anos, isso deve levantar a suspeita de FPI e levar à consideração de uma TCAR do tórax, que é mais sensível do que uma radiografia do tórax.[12] Como as crepitações não são específicas para FPI, elas devem levar a um processo de diagnóstico completo.[3]
Causas
[editar | editar código-fonte]A causa da FPI é desconhecida, mas foi demonstrado que determinados fatores ambientais e exposições aumentam o risco de contrair a doença.[14] O tabagismo é o fator de risco mais reconhecido e aceito para a FPI, e aumenta o risco em cerca de duas vezes.[14] Outras exposições ambientais e ocupacionais, como exposição a poeira metálica, poeira de madeira, poeira de carvão, sílica, poeira de pedra, poeiras biológicas provenientes de poeira de feno ou esporos de mofo ou outros produtos agrícolas, e ocupações relacionadas à agricultura/pecuária também demonstraram aumentar o risco de FPI.[14] Há algumas evidências de que infecções virais podem estar associadas à fibrose pulmonar idiopática e a outras doenças pulmonares fibróticas.[15]
Patogênese
[editar | editar código-fonte]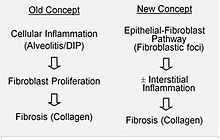
Apesar da extensa investigação, a causa da FPI permanece desconhecida.[3] A fibrose na FPI tem sido associada ao tabagismo, a fatores ambientais (por exemplo, exposição ocupacional a gases, fumaça, produtos químicos ou poeiras), a outras condições médicas, incluindo a doença do refluxo gastroesofágico (DRGE), ou à predisposição genética (FPI familiar). Entretanto, nenhum desses fatores está presente em todas as pessoas com a doença e, portanto, não fornecem uma explicação completamente satisfatória para a doença.[3][16]
Acredita-se que a FPI seja o resultado de um processo aberrante de cicatrização de feridas, incluindo/envolvendo a deposição anormal e excessiva de colágeno (fibrose) no interstício pulmonar, com inflamação mínima associada.[17] Suspeita-se que a senescência celular seja uma causa central, uma crença que é apoiada pelos benefícios observados em pacientes que receberam terapia senolítica.[18][19][20]
A hipótese é que a lesão inicial ou repetitiva na FPI ocorra nas células pulmonares, chamadas células epiteliais alveolares (pneumócitos), que revestem a maior parte da superfície alveolar.[21] Quando os pneumócitos do tipo I são danificados ou perdidos, acredita-se que os pneumócitos do tipo II sofram proliferação para cobrir as membranas basais expostas. No reparo normal, os pneumócitos hiperplásicos do tipo II morrem e as células restantes se espalham e passam por um processo de diferenciação para se tornarem pneumócitos do tipo I. Em condições patológicas e na presença do fator de transformação do crescimento beta (TGF-β), os fibroblastos se acumulam nessas áreas de dano e se diferenciam em miofibroblastos que secretam colágeno e outras proteínas.[21] Na classificação atual da patogênese da FPI, acredita-se que ela ocorra por meio da formação de uma lesão de PIU (pneumonia intersticial usual), que então passa pela condição patológica característica da FPI mencionada anteriormente.[22] Outros mecanismos de lesões repetidas propostos indicam que a FPI pode resultar não apenas de uma lesão pneumonia intersticial idiopática (PII), mas também de lesões pneumonia intersticial não específica (PINE) e lesão alveolar difusa (LAD),[23] ou de uma combinação de várias delas.
No passado, acreditava-se que a inflamação era o primeiro evento no início da formação de cicatrizes no tecido pulmonar. Descobertas posteriores mostraram que o desenvolvimento de focos fibroblásticos precede o acúmulo de células inflamatórias e a consequente deposição de colágeno.[24] Esse modelo patogenético é indiretamente apoiado pelas características clínicas da FPI, incluindo um início insidioso ao longo de vários anos, exacerbações agudas relativamente infrequentes e falha na resposta à terapia imunossupressora.[17][25] No entanto, alguns pesquisadores acreditam que a doença é multimecanística, em que o desencadeamento da doença pode resultar de anormalidades em qualquer número de vias de cicatrização de feridas, incluindo a resposta inflamatória.[23] Tais anormalidades poderiam ocorrer em qualquer número das nove vias implicadas (cascata de coagulação, vias antioxidantes, apoptose, citocinas inflamatórias, angiogênese e remodelação vascular, fatores de crescimento, surfactante e fatores reguladores da matriz),[23] e que, por meio de uma investigação mais aprofundada de todas as nove, novas terapias e abordagens poderiam ser propostas em uma base única ou caso a caso, caso as tentativas de tratar ou contornar complicações em qualquer via não fossem bem-sucedidas. Várias terapias que têm como alvo a ativação de fibroblastos ou a síntese da matriz extracelular estão atualmente em testes iniciais ou estão sendo consideradas para desenvolvimento.
A FPI familiar é responsável por menos de 5% do total de pacientes e é clínica e histologicamente indistinguível da FPI esporádica.[3] As associações genéticas incluem mutações nas proteínas do surfactante pulmonar A1, A2, C (SFTPA1, SFTPA2B) e mucina (MUC5B).[26] Um aspecto notável da variante MUC5B é sua alta frequência de detecção, pois ela é encontrada em aproximadamente 20% dos indivíduos com ascendência da Europa do Norte e Ocidental e em 19% da população do Estudo de Framingham.[27] As mutações nos genes da telomerase humana também estão associadas à fibrose pulmonar familiar e em alguns pacientes com FPI esporádica (por exemplo, os genes TERT e TERC).[26] Recentemente, uma mutação ligada ao cromossomo X em um terceiro gene associado à telomerase, a disquerina (DKC1), foi descrita em uma família com FPI.[28]
Diagnóstico
[editar | editar código-fonte]Um diagnóstico precoce da FPI é um pré-requisito para o tratamento precoce e, potencialmente, para a melhoria do resultado clínico de longo prazo dessa doença progressiva e, em última análise, fatal.[3] Se houver suspeita de FPI, o diagnóstico pode ser desafiador, mas uma abordagem multidisciplinar envolvendo um pneumologista, radiologista e patologista especialista em doença pulmonar intersticial demonstrou melhorar a precisão do diagnóstico da FPI.[3][29][30]
Uma Declaração de Consenso Multidisciplinar sobre Pneumonias Intersticiais Idiopáticas publicada pela Sociedade Torácica Americana (American Thoracic Society - ATS) e pela Sociedade Respiratória Europeia (European Respiratory Society - ERS) em 2000 propôs critérios maiores e menores específicos para estabelecer o diagnóstico de FPI.[3] No entanto, em 2011, novos critérios simplificados e atualizados para o diagnóstico e o tratamento da FPI foram publicados pela ATS, ERS, juntamente com a Sociedade Respiratória Japonesa (Japanese Respiratory Society - JRS) e a Associação Latino-Americana do Tórax (Latin American Thoracic Association - ALAT).[3] Atualmente, o diagnóstico de FPI requer:
- Exclusão de causas conhecidas de DPI, por exemplo, exposições ambientais domésticas e ocupacionais, distúrbios do tecido conectivo ou exposição/toxicidade a medicamentos.
- A presença de um padrão radiológico típico de PII na tomografia computadorizada de alta resolução (TCAR).
No cenário clínico correto, é possível fazer o diagnóstico de FPI somente pela TCAR, evitando a necessidade de biópsia pulmonar cirúrgica.
Várias tecnologias que utilizam Inteligência Artificial foram desenvolvidas para ajudar no diagnóstico. Um algoritmo de aprendizagem profunda para categorizar imagens de TC de alta resolução relatou alta precisão[31] e um projeto de pesquisa liderado pela Faculdade de Pós-Graduação em Medicina da Universidade de Nagoya e pela Riken usou uma combinação de algoritmo de aprendizagem profunda e de aprendizagem de máquina para diagnosticar a doença com precisão.[32]
Diagnóstico diferencial
[editar | editar código-fonte]Reconhecer a FPI na prática clínica pode ser um desafio, pois os sintomas geralmente são semelhantes aos de doenças mais comuns, como asma, doença pulmonar obstrutiva crônica (DPOC) e insuficiência cardíaca congestiva. A principal questão que os médicos enfrentam é se a história, os sintomas (ou sinais), a radiologia e os testes de função pulmonar apresentados estão coletivamente de acordo com o diagnóstico de FPI ou se os achados se devem a outro processo. Há muito tempo se reconhece que pacientes com DPI relacionada à exposição ao amianto, medicamentos (como agentes quimioterápicos ou nitrofurantoína), artrite reumatoide e esclerodermia/esclerose sistêmica podem ser difíceis de distinguir da FPI. Outras considerações diagnósticas diferenciais incluem DPI relacionada à doença mista do tecido conjuntivo, sarcoidose avançada, pneumonite de hipersensibilidade crônica, histiocitose pulmonar de células de Langerhan e lesão pulmonar induzida por radiação.[2][9]
Classificação
[editar | editar código-fonte]
A fibrose pulmonar idiopática (FPI) pertence a um grande grupo de mais de 200 doenças pulmonares conhecidas como doenças pulmonares intersticiais (DPIs), que são caracterizadas pelo envolvimento do interstício pulmonar,[9] o tecido entre os sacos aéreos do pulmão. A FPI é uma apresentação específica da pneumonia intersticial idiopática (PII), que, por sua vez, é um tipo de DPI, também conhecida como doença pulmonar parenquimatosa difusa.
A classificação das PIIs da ATS e ERS de 2002 foi atualizada em 2013.[9] Nessa nova classificação, há três categorias principais de pneumonias intersticiais idiopáticas (PIIs): PIIs principais, PIIs raras e PIIs não classificáveis. As principais PIIs são agrupadas em PIIs fibrosantes crônicas (incluindo FPI e pneumonia intersticial não específica [PINE]); PIIs relacionadas ao tabagismo (ou seja, bronquiolite respiratória - doença pulmonar intersticial [BR-DPI] e pneumonia intersticial descamativa [PID]); e PIIs agudas/subagudas (ou seja, pneumonia organizativa criptogênica [COP] e pneumonia intersticial aguda [PIA]).[9]
O diagnóstico de PIIs requer a exclusão de causas conhecidas de DPI. Exemplos de DPI de causa conhecida incluem pneumonite por hipersensibilidade, histiocitose pulmonar de células de Langerhan, asbestose e doença vascular do colágeno. No entanto, esses distúrbios frequentemente afetam não apenas o interstício, mas também os espaços aéreos, as vias aéreas periféricas e os vasos sanguíneos.[9]
Radiologia
[editar | editar código-fonte]As radiografias de tórax são úteis na rotina de acompanhamento de pacientes com FPI. Infelizmente, as radiografias simples de tórax não são diagnósticas, mas podem revelar volumes pulmonares reduzidos, geralmente com marcas intersticiais reticulares proeminentes próximas às bases pulmonares.[3]

A avaliação radiológica por meio da TCAR é um ponto essencial no caminho do diagnóstico da FPI. A TCAR é realizada usando um scanner tomográfico axial computadorizado convencional sem injeção de agentes de contraste. As fatias de avaliação são muito finas, de 1 a 2 mm.
A TCAR típica do tórax da FPI demonstra alterações fibróticas em ambos os pulmões, com predileção pelas bases e pela periferia. De acordo com as diretrizes conjuntas das ATS, ERS, JRS e ALAT de 2011, a TCAR é um componente essencial da via diagnóstica na FPI, que pode identificar a PIU pela presença de:[3]
- Opacidades reticulares, geralmente associadas a bronquiectasias de tração
- Favos de mel manifestados como espaços aéreos císticos agrupados, geralmente de diâmetros comparáveis (3-10 mm), mas ocasionalmente grandes. Geralmente são subpleurais e caracterizados por paredes bem definidas e dispostos em pelo menos duas linhas. Em geral, uma linha de cistos não é suficiente para definir os favos de mel.
- Opacidades de vidro fosco são comuns, mas menos extensas do que a reticulação.
- Distribuição caracteristicamente basal e periférica, embora muitas vezes irregular.

Tomografia computadorizada de alta resolução do tórax de um paciente com FPI. As principais características são um padrão periférico, predominantemente basal, de reticulação grosseira com favos de mel
Histologia
[editar | editar código-fonte]De acordo com as diretrizes atualizadas de 2011, na ausência de um padrão típico de PIU na TCAR, é necessária uma biópsia pulmonar cirúrgica para um diagnóstico seguro.[3]
As amostras histológicas para o diagnóstico de FPI devem ser obtidas em pelo menos três locais diferentes e ser grandes o suficiente para que o patologista possa comentar sobre a arquitetura pulmonar subjacente. Biópsias pequenas, como as obtidas por meio de biópsia pulmonar transbrônquica (realizada durante a broncoscopia), geralmente não são suficientes para essa finalidade. Portanto, geralmente são necessárias biópsias maiores obtidas cirurgicamente por meio de toracotomia ou toracoscopia.[3][9]
O tecido pulmonar de pessoas com FPI geralmente apresenta um padrão histopatológico característico de PIU e, portanto, é a contraparte patológica da FPI.[3] Embora um diagnóstico patológico de PIU geralmente corresponda a um diagnóstico clínico de FPI, um padrão histológico de PIU também pode ser observado em outras doenças e na fibrose de origem conhecida (doenças reumáticas, por exemplo).[1][3] Há quatro características principais da PIU, incluindo fibrose intersticial em um "padrão de retalhos", cicatrizes intersticiais, alterações em favo de mel e focos de fibroblastos.
Os focos fibroblásticos são coleções densas de miofibroblastos e tecido cicatricial e, juntamente com a formação de favos de mel, são os principais achados patológicos que permitem o diagnóstico de PIU.

Lavado broncoalveolar
[editar | editar código-fonte]O lavado broncoalveolar (LBA) é um procedimento diagnóstico bem tolerado na DPI.[10] As análises citológicas do LBA (contagens diferenciais de células) devem ser consideradas na avaliação de pacientes com FPI, a critério do médico responsável pelo tratamento, com base na disponibilidade e na experiência de sua instituição. O LBA pode revelar diagnósticos específicos alternativos: malignidade, infecções, pneumonia eosinofílica, histiocitose X ou proteinose alveolar. Na avaliação de pacientes com suspeita de FPI, a aplicação mais importante do LBA é a exclusão de outros diagnósticos. A linfocitose proeminente (>30%) geralmente permite excluir o diagnóstico de FPI.[33]
Testes de função pulmonar
[editar | editar código-fonte]A espirometria classicamente revela uma redução na capacidade vital (CV) com uma redução proporcional nos fluxos de ar ou um aumento nos fluxos de ar para a CV observada. Esse último achado reflete o aumento da rigidez pulmonar (redução da complacência pulmonar) associado à fibrose pulmonar, que leva ao aumento do recuo elástico do pulmão.[34]
A medição de volumes pulmonares estáticos usando pletismografia corporal ou outras técnicas geralmente revela volumes pulmonares reduzidos (restrição). Isso reflete a dificuldade encontrada para inflar os pulmões fibróticos.
A capacidade de difusão do monóxido de carbono (DLCO) é invariavelmente reduzida na FPI e pode ser a única anormalidade na doença leve ou inicial. Seu comprometimento está subjacente à propensão dos pacientes com FPI a apresentar dessaturação de oxigênio durante o exercício, o que também pode ser avaliado por meio do teste de caminhada de 6 minutos (TC6M).[3]
Termos como "leve", "moderado" e "grave" são às vezes usados para o estadiamento da doença e são comumente baseados em medições de testes de função pulmonar em repouso.[3] No entanto, não há um consenso claro sobre o estadiamento de pacientes com FPI e quais são os melhores critérios e valores a serem usados. A FPI leve a moderada tem sido caracterizada pelos seguintes critérios funcionais:[35][36][37][38]
- Capacidade vital forçada (CVF) de ≥50%.
- DLCO de ≥30%.
- Distância do TC6M ≥150 metros.
Tratamento
[editar | editar código-fonte]Os objetivos do tratamento na FPI são essencialmente reduzir os sintomas, interromper a progressão da doença, evitar exacerbações agudas e prolongar a sobrevida. Os cuidados preventivos (por exemplo, vacinas) e o tratamento baseado em sintomas devem ser iniciados precocemente em todos os pacientes.[39]
Terapia com oxigênio
[editar | editar código-fonte]Nas diretrizes de 2011 da FPI, a oxigenoterapia, ou oxigênio suplementar para uso doméstico, tornou-se uma forte recomendação para uso em pacientes com níveis de oxigênio significativamente baixos em repouso. Embora não tenha sido demonstrado que a oxigenoterapia melhore a sobrevida na FPI, alguns dados indicam uma melhora na capacidade de exercício.[3][40]
Reabilitação pulmonar
[editar | editar código-fonte]A fadiga e a perda de massa muscular são problemas comuns e incapacitantes para os pacientes com FPI. A reabilitação pulmonar pode aliviar os sintomas evidentes da FPI e melhorar o estado funcional, estabilizando e/ou revertendo as características extrapulmonares da doença.[41][42] O número de estudos publicados sobre o papel da reabilitação pulmonar na fibrose pulmonar idiopática é pequeno, mas a maioria desses estudos constatou melhorias significativas em curto prazo na tolerância funcional ao exercício, na qualidade de vida e na dispneia aos esforços.[43] Os programas típicos de reabilitação incluem treinamento de exercícios, modulação nutricional, terapia ocupacional, educação e aconselhamento psicossocial. Na fase tardia da doença, os pacientes com FPI tendem a interromper a atividade física devido ao aumento da dispneia. Sempre que possível, isso deve ser desencorajado.
Medicações
[editar | editar código-fonte]Diversos tratamentos foram investigados no passado para a FPI, incluindo interferão gama-1β,[44] bosentana,[45] ambrisentana,[46] e anticoagulantes,[47] mas eles não são mais considerados opções de tratamento eficazes. Muitos desses estudos anteriores foram baseados na hipótese de que a FPI é um distúrbio inflamatório.
Pirfenidona
[editar | editar código-fonte]Uma revisão da Cochrane comparando a pirfenidona com placebo constatou uma redução de 30% no risco de progressão da doença.[48] A CVF ou CV também melhorou, mesmo que uma leve desaceleração no declínio da CVF tenha sido demonstrada apenas em um dos dois estudos CAPACITY.[35] Um terceiro estudo, concluído em 2014, constatou redução do declínio da função pulmonar e da progressão da doença na FPI.[37] Os dados do estudo ASCEND também foram combinados com os dados dos dois estudos CAPACITY em uma análise pré-especificada que mostrou que a pirfenidona reduziu o risco de morte em quase 50% em um ano de tratamento.[37]
N-acetilcisteína e terapia tripla
[editar | editar código-fonte]A N-acetilcisteína (NAC) é um precursor da glutationa, um antioxidante. Foi levantada a hipótese de que o tratamento com altas doses de NAC pode reparar um desequilíbrio entre oxidantes e antioxidantes que ocorre no tecido pulmonar de pacientes com FPI. No primeiro estudo clínico com 180 pacientes (IFIGENIA), a NAC demonstrou, em estudo anterior, reduzir o declínio da CV e da DLCO ao longo de 12 meses de acompanhamento quando usada em combinação com prednisona e azatioprina (terapia tripla).[49]
Mais recentemente, um grande estudo randomizado e controlado (PANTHER-IPF) foi realizado pelo Institutos Nacionais da Saúde (National Institutes of Health - NIH) nos EUA para avaliar a terapia tripla e a monoterapia com NAC em pacientes com FPI. Esse estudo constatou que a combinação de prednisona, azatioprina e NAC aumentou o risco de morte e hospitalizações[50] e o NIH anunciou em 2012 que o braço de terapia tripla do estudo PANTHER-IPF havia sido encerrado precocemente.[51]
Esse estudo também avaliou a NAC isoladamente e os resultados desse braço do estudo foram publicados em maio de 2014 no The New England Journal of Medicine, concluindo que "em comparação com o placebo, a acetilcisteína não ofereceu nenhum benefício significativo com relação à preservação da CVF em pacientes com fibrose pulmonar idiopática com comprometimento leve a moderado da função pulmonar".[52]
Nintedanibe
[editar | editar código-fonte]O nintedanibe é um inibidor triplo de angioquinase que tem como alvo os receptores tirosina quinases envolvidos na regulação da angiogênese: receptor do fator de crescimento de fibroblastos (FGFR), receptor do fator de crescimento derivado de plaquetas (PDGFR) e receptor do fator de crescimento endotelial vascular (VEGFR),[53] que também foram implicados na patogênese da fibrose e da FPI. Em ambos os estudos de fase III, o nintedanibe reduziu o declínio da função pulmonar em aproximadamente 50% em um ano.[38] Foi aprovado pela FDA dos EUA em outubro de 2014[54] e autorizado na Europa em janeiro de 2015.[55]
Transplante de pulmão
[editar | editar código-fonte]O transplante de pulmão pode ser adequado para os pacientes fisicamente elegíveis para serem submetidos a uma grande operação de transplante. Em pacientes com FPI, foi demonstrado que o transplante de pulmão reduz o risco de morte em 75% em comparação com pacientes que permanecem na lista de espera.[56] Desde a introdução do escore de alocação de pulmão (lung allocation score - LAS), que prioriza os candidatos a transplante com base na probabilidade de sobrevivência, a FPI tornou-se a indicação mais comum para transplante de pulmão nos EUA.[41]
Pacientes sintomáticos com FPI com menos de 65 anos de idade e com um índice de massa corporal (IMC) ≤26 kg/m² devem ser encaminhados para transplante de pulmão, mas não há dados claros que orientem o momento exato para o LTx. Embora controversos, os dados mais recentes sugerem que o transplante pulmonar bilateral é superior ao transplante pulmonar único em pacientes com FPI.[57] As taxas de sobrevida em cinco anos após o transplante pulmonar na FPI são estimadas entre 50 e 56%.[3][58][59]
Cuidados paliativos
[editar | editar código-fonte]O cuidado paliativo se concentra na redução dos sintomas e na melhora do conforto dos pacientes, em vez de tratar a doença. Isso pode incluir o tratamento da piora dos sintomas com o uso de opioides crônicos para dispneia grave e tosse. Além disso, a oxigenoterapia pode ser útil para paliar a dispneia em pacientes hipoxêmicos.
Os cuidados paliativos também incluem o alívio do sofrimento físico e emocional e o apoio psicossocial para pacientes e cuidadores.[3] Com a progressão da doença, os pacientes podem sentir medo, ansiedade e depressão e, portanto, deve-se considerar o aconselhamento psicológico. Em um estudo recente de pacientes ambulatoriais com DPIs, incluindo FPI, o escore de depressão, o status funcional (avaliado pelo teste de caminhada) e a função pulmonar contribuíram para a gravidade da dispneia.[60]
Em casos selecionados de dispneia particularmente grave, a morfina pode ser considerada. Ela pode reduzir a dispneia, a ansiedade e a tosse sem diminuir significativamente a saturação de oxigênio.[61]
Acompanhamento
[editar | editar código-fonte]A FPI é frequentemente diagnosticada erroneamente, pelo menos até que os dados fisiológicos e/ou de imagem sugiram a presença de uma DPI, o que leva a um atraso no acesso ao atendimento adequado.[41] Considerando que a FPI é uma doença com uma sobrevida média de três anos após o diagnóstico, o encaminhamento precoce a um centro com especialização específica deve, portanto, ser considerado para qualquer paciente com DPI suspeita ou conhecida. Com base no complexo diagnóstico diferencial, a discussão multidisciplinar entre pneumologistas, radiologistas e patologistas com experiência no diagnóstico de DPI é de extrema importância para um diagnóstico preciso.[3]
As pessoas com FPI têm maiores chances de desenvolver câncer de pulmão, com uma taxa de 13,5%, sendo que o tipo de câncer mais comum é o carcinoma de células escamosas do pulmão.[62] É obrigatória uma avaliação de rotina a cada 3 a 6 meses, incluindo espirometria (pletismografia corporal), teste de capacidade de difusão, radiografias de tórax, TC6M, avaliação da dispneia, qualidade de vida e necessidade de oxigênio.
Além disso, a crescente conscientização das complicações e condições concomitantes comuns frequentemente associadas à FPI exige uma avaliação rotineira das comorbidades, a maioria delas simplesmente refletindo doenças concomitantes do envelhecimento e medicamentos com suas interações e efeitos colaterais.
Exacerbações agudas
[editar | editar código-fonte]As exacerbações agudas da FPI (IPF-AE) são definidas como uma piora inexplicável ou desenvolvimento de dispneia dentro de 30 dias com novos infiltrados radiológicos na anormalidade da TCAR, muitas vezes sobrepostos em um fundo consistente com o padrão UIP. A incidência anual de AE-IPF está entre 10 e 15% de todos os pacientes. O prognóstico da FPI-AE é ruim, com mortalidade variando de 78% a 96%.[63] Outras causas de FPI-AE, como embolia pulmonar, insuficiência cardíaca congestiva, pneumotórax ou infecção, precisam ser excluídas. A infecção pulmonar deve ser excluída por meio de aspirado endotraqueal ou LBA.
Muitos pacientes com deterioração aguda precisam de tratamento de terapia intensiva, principalmente quando a insuficiência respiratória está associada à instabilidade hemodinâmica, a comorbidades significativas ou à hipoxemia grave.[64] No entanto, a mortalidade durante a hospitalização é alta.[63] A ventilação mecânica deve ser introduzida somente depois de se avaliar cuidadosamente o prognóstico de longo prazo da pessoa e, sempre que possível, a vontade dela. No entanto, as diretrizes atuais desencorajam o uso de ventilação mecânica em pacientes com insuficiência respiratória secundária à FPI.[3]
Prognóstico
[editar | editar código-fonte]
O curso clínico da FPI pode ser imprevisível.[3][65][66] A progressão da FPI está associada a um tempo de sobrevida médio estimado de 2 a 5 anos após o diagnóstico.[1][3] A sobrevida em 5 anos para a FPI varia entre 20 e 40%,[66] uma taxa de mortalidade maior do que a de várias doenças malignas, incluindo câncer de cólon, mieloma múltiplo e câncer de bexiga.[65][66]
Recentemente, um índice multidimensional e um sistema de estadiamento foram propostos para prever a mortalidade na FPI.[67] O nome do índice é GAP e baseia-se no gênero (G), na idade (A) e em duas variáveis de fisiologia pulmonar (P) (FVC e DLCO, que são comumente medidas na prática clínica para prever a mortalidade na FPI). Descobriu-se que o estágio mais alto do GAP (estágio III) está associado a um risco de 39% de mortalidade em um ano.[67] Esse modelo também foi avaliado na FPI e em outras DPIs e mostrou bom desempenho na previsão de mortalidade em todos os principais subtipos de DPI. Um índice ILD-GAP modificado foi desenvolvido para aplicação em todos os subtipos de DPI para fornecer estimativas de sobrevivência específicas da doença.[68] Em pacientes com FPI, a taxa de mortalidade geral em 5 anos é alta, mas a taxa anual de mortalidade por todas as causas em pacientes com comprometimento pulmonar leve a moderado é relativamente baixa. Essa é a razão pela qual a mudança na função pulmonar (FVC) é geralmente medida em ensaios clínicos de 1 ano de tratamentos de FPI em vez de sobrevida.[69]
Além dos parâmetros clínicos e fisiológicos para prever a rapidez com que os pacientes com FPI podem progredir, as características genéticas e moleculares também estão associadas à mortalidade da FPI. Por exemplo, foi demonstrado que os pacientes com FPI que têm um genótipo específico no polimorfismo do gene da mucina MUC5B apresentam um declínio mais lento na FVC e uma sobrevida significativamente melhor.[70][71] Mesmo que esses dados sejam interessantes do ponto de vista científico, a aplicação na rotina clínica de um modelo prognóstico baseado em genótipos específicos ainda não é possível.
Epidemiologia
[editar | editar código-fonte]Embora rara, a FPI é a forma mais comum de PII.[9] A prevalência da FPI foi estimada entre 14,0 e 42,7 por 100.000 pessoas com base em uma análise dos EUA de dados de reclamações de assistência médica, com variação dependendo das definições de caso usadas nessa análise.[11][72] A FPI é mais comum em homens do que em mulheres e geralmente é diagnosticada em pessoas com mais de 50 anos de idade.[3]
É difícil determinar a incidência da FPI, pois não foram aplicados critérios diagnósticos uniformes de forma consistente.[3][11] Um estudo recente dos EUA estimou a incidência da FPI entre 6,8 e 16,3 por 100.000 pessoas. Nos 27 países da União Europeia, uma série de fontes estima uma incidência de 4,6 a 7,4 pessoas por 100.000 habitantes,[73][74] sugerindo que aproximadamente 30.000 a 35.000 novos pacientes serão diagnosticados com FPI a cada ano.[72][75]
Um estudo recente de coorte observacional, retrospectivo e em um único centro, que incluiu pacientes incidentes diagnosticados com DPI no Hospital Universitário de Aarhus (Dinamarca) entre 2003 e 2009, revelou uma incidência de 4,1 por 100.000 habitantes/ano para DPI. A FPI foi o diagnóstico mais comum (28%), seguido por DPI relacionada a doenças do tecido conjuntivo (14%), pneumonite por hipersensibilidade (7%) e pneumonia intersticial não específica (PINE) (7%). A incidência de FPI foi de 1,3 por 100.000 habitantes/ano.[76]
Devido à distribuição heterogênea da doença nos países europeus, os dados epidemiológicos precisam ser atualizados por meio de um registro europeu de DPI e FPI.
Outros animais
[editar | editar código-fonte]A FPI foi reconhecida em várias raças de cães e gatos,[77] e foi mais bem caracterizada em West Highland White Terriers.[78] Os pacientes veterinários com a doença compartilham muitos dos mesmos sinais clínicos que os humanos, incluindo intolerância progressiva ao exercício, aumento da frequência respiratória e eventual dificuldade respiratória.[79] O prognóstico geralmente é ruim.
Pesquisa
[editar | editar código-fonte]Vários agentes estão sendo investigados atualmente em estudos clínicos de fase II para FPI, incluindo os anticorpos monoclonais simtuzumabe, tralokinumabe, lebrikizumabe e FG-3019, um antagonista do receptor do ácido lisofosfatídico (BMS-986020). Um estudo de fase II do STX-100 também está em andamento.[80] Essas moléculas são direcionadas contra vários fatores de crescimento e citocinas que são conhecidos por desempenhar um papel na proliferação, ativação, diferenciação ou sobrevivência inadequada de fibroblastos.
As investigações do precursor de microRNA mir-29 em camundongos produziram reversão da FPI induzida. O MRG-201 está sendo testado desde 2016, mas ainda não em pacientes com FPI, e nenhum teste em humanos para uso em FPI foi programado até janeiro de 2016.[81]
As terapias com células-tronco para FPI são uma área de pesquisa.[82][83]
Foi proposto um algoritmo de aprendizado de máquina que descobre padrões sutis no histórico individual de encontros médicos para estimar de forma confiável o risco de um futuro diagnóstico de FPI, até quatro anos antes da prática médica atual.[84] O algoritmo gera uma pontuação (ZCoR) usando o histórico médico registrado sem novos testes e pode ser implantado como uma ferramenta universal de triagem de FPI na atenção primária. O ZCoR foi treinado e validado em quase 3 milhões de pacientes em vários bancos de dados, alcançando alto desempenho preditivo em dados fora da amostra (razão de verossimilhança positiva > 30 com 99% de especificidade). Os autores concluem que os distúrbios respiratórios anteriores contribuem ao máximo para o risco de FPI, seguidos por comorbidades conhecidas de FPI, doenças metabólicas, anormalidades cardiovasculares e doenças oculares, com o padrão geral da classificação de importância substancialmente invariável entre os sexos.
Veja também
[editar | editar código-fonte]- Sistema respiratório
- Pulmão
- Fibrose pulmonar
- Doença pulmonar intersticial (DPI)
- Pneumonia intersticial idiopática (PII)
- Transplante de pulmão
- Oxigenoterapia
Referências
- ↑ a b c d e f g h i j k l m n o «Idiopathic Pulmonary Fibrosis». NHLBI. Consultado em 21 de janeiro de 2018
- ↑ a b c d e Raghu, Ganesh; Rochwerg, Bram; Zhang, Yuan; Garcia, Carlos A. Cuello; Azuma, Arata; Behr, Juergen; Brozek, Jan L.; Collard, Harold R.; Cunningham, William (15 de julho de 2015). «An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline: Treatment of Idiopathic Pulmonary Fibrosis. An Update of the 2011 Clinical Practice Guideline». American Journal of Respiratory and Critical Care Medicine (em inglês) (2): e3–e19. ISSN 1073-449X. doi:10.1164/rccm.201506-1063ST
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Raghu, Ganesh; Collard, Harold R.; Egan, Jim J.; Martinez, Fernando J.; Behr, Juergen; Brown, Kevin K.; Colby, Thomas V.; Cordier, Jean-François; Flaherty, Kevin R. (15 de março de 2011). «An Official ATS/ERS/JRS/ALAT Statement: Idiopathic Pulmonary Fibrosis: Evidence-based Guidelines for Diagnosis and Management». American Journal of Respiratory and Critical Care Medicine (em inglês) (6): 788–824. ISSN 1073-449X. doi:10.1164/rccm.2009-040GL
- ↑ a b c d e Ferri FF (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1 (em inglês). [S.l.]: Elsevier Health Sciences. p. 691. ISBN 9780323529570
- ↑ Todd, Nevins W; Luzina, Irina G; Atamas, Sergei P (dezembro de 2012). «Molecular and cellular mechanisms of pulmonary fibrosis». Fibrogenesis & Tissue Repair (em inglês) (1). ISSN 1755-1536. PMID 22824096. doi:10.1186/1755-1536-5-11
- ↑ «Idiopathic Pulmonary Fibrosis». NHLBI, NIH. Consultado em 5 de dezembro de 2020
- ↑ a b Meltzer EB, Noble PW (2008). «Idiopathic pulmonary fibrosis». Orphanet Journal of Rare Diseases. 3 (1). 8 páginas. PMC 2330030
 . PMID 18366757. doi:10.1186/1750-1172-3-8
. PMID 18366757. doi:10.1186/1750-1172-3-8
- ↑ Raghu, Ganesh; Remy-Jardin, Martine; Richeldi, Luca; Thomson, Carey C.; Inoue, Yoshikazu; Johkoh, Takeshi; Kreuter, Michael; Lynch, David A.; Maher, Toby M.; Martinez, Fernando J.; Molina-Molina, Maria; Myers, Jeffrey L.; Nicholson, Andrew G.; Ryerson, Christopher J.; Strek, Mary E. (1 de maio de 2022). «Idiopathic Pulmonary Fibrosis (an Update) and Progressive Pulmonary Fibrosis in Adults: An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline». American Journal of Respiratory and Critical Care Medicine. 205 (9): e18–e47. ISSN 1073-449X. PMC 9851481
 . PMID 35486072. doi:10.1164/rccm.202202-0399ST
. PMID 35486072. doi:10.1164/rccm.202202-0399ST
- ↑ a b c d e f g h i Travis WD, Costabel U, Hansell DM, King TE, Lynch DA, Nicholson AG, et al. (setembro de 2013). «An official American Thoracic Society/European Respiratory Society statement: Update of the international multidisciplinary classification of the idiopathic interstitial pneumonias». American Journal of Respiratory and Critical Care Medicine. 188 (6): 733–48. PMC 5803655
 . PMID 24032382. doi:10.1164/rccm.201308-1483ST
. PMID 24032382. doi:10.1164/rccm.201308-1483ST
- ↑ a b Flaherty KR, Mumford JA, Murray S, Kazerooni EA, Gross BH, Colby TV, Travis WD, Flint A, et al. (2007). «Prognostic implications of physiologic and radiographic changes in idiopathic interstitial pneumonia». American Journal of Respiratory and Critical Care Medicine. 168 (5): 543–548. CiteSeerX 10.1.1.320.6411
 . PMID 12773329. doi:10.1164/rccm.200209-1112OC
. PMID 12773329. doi:10.1164/rccm.200209-1112OC
- ↑ a b c Raghu G, Weycker D, Edesberg J, Bradford WZ, Oster G (2006). «Incidence and prevalence of idiopathic pulmonary fibrosis». American Journal of Respiratory and Critical Care Medicine. 174 (7): 810–816. PMID 16809633. doi:10.1164/rccm.200602-163oc
- ↑ a b Cottin V, Cordier JF (2012). «Velcro crackles: the key for early diagnosis of idiopathic pulmonary fibrosis». European Respiratory Journal. 40 (3): 519–521. PMID 22941541. doi:10.1183/09031936.00001612

- ↑ Baughman RP, Shipley RT, Loudon RG, Lower EE (1991). «Crackles in interstitial lung disease. Comparison of sarcoidosis and fibrosing alveolitis». Chest. 100 (1): 96–101. PMID 2060395. doi:10.1378/chest.100.1.96
- ↑ a b c Olson AL, Swigris JJ (Mar 2012). «Idiopathic pulmonary fibrosis: diagnosis and epidemiology». Clinics in Chest Medicine. 33 (1): 41–50. PMID 22365244. doi:10.1016/j.ccm.2011.12.001
- ↑ Williams, KJ (março de 2014). «Gammaherpesviruses and Pulmonary Fibrosis: Evidence From Humans, Horses, and Rodents». Veterinary Pathology. 51 (2): 372–384. PMID 24569614. doi:10.1177/0300985814521838
- ↑ García-Sancho C, Buendía-Roldán I, Fernández-Plata MR, Navarro C, Pérez-Padilla R, Vargas MH, et al. (dezembro de 2011). «Familial pulmonary fibrosis is the strongest risk factor for idiopathic pulmonary fibrosis». Respiratory Medicine. 105 (12): 1902–7. PMID 21917441. doi:10.1016/j.rmed.2011.08.022

- ↑ a b Harari S, Caminati A (2010). «IPF: new insight on pathogenesis and treatment». Allergy. 65 (5): 537–553. PMID 20121758. doi:10.1111/j.1398-9995.2009.02305.x
- ↑ Justice JN, Nambiar AM, Tchkonia T, Kirkland JL (2019). «Senolytics in idiopathic pulmonary fibrosis: Results from a first-in-human, open-label, pilot study». EBioMedicine. 40: 554–563. PMC 6412088
 . PMID 30616998. doi:10.1016/j.ebiom.2018.12.052
. PMID 30616998. doi:10.1016/j.ebiom.2018.12.052
- ↑ Palmer AK, Gustafson B, Kirkland JL, Smith U (2019). «Cellular senescence: at the nexus between ageing and diabetes». Diabetologia. 62 (10): 1835–1841. PMC 6731336
 . PMID 31451866. doi:10.1007/s00125-019-4934-x
. PMID 31451866. doi:10.1007/s00125-019-4934-x
- ↑ Kirkland JL, Tchkonia T (2020). «Senolytic Drugs: From Discovery to Translation». Journal of Internal Medicine. 288 (5): 518–536. PMC 7405395
 . PMID 32686219. doi:10.1111/joim.13141
. PMID 32686219. doi:10.1111/joim.13141
- ↑ a b Loomis-King H, Flaherty KR, Moore BB (junho de 2013). «Pathogenesis, current treatments and future directions for idiopathic pulmonary fibrosis». Current Opinion in Pharmacology. 13 (3): 377–385. PMC 3686907
 . PMID 23602652. doi:10.1016/j.coph.2013.03.015
. PMID 23602652. doi:10.1016/j.coph.2013.03.015
- ↑ Raghu G, Remy-Jardin M, Myers JL, Richeldi L, Ryerson CJ, Lederer DJ, et al. (setembro de 2018). «Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline». American Journal of Respiratory and Critical Care Medicine. 198 (5): e44–e68. PMID 30168753. doi:10.1164/rccm.201807-1255ST
- ↑ a b c Maher TM, Wells AU, Laurent GJ (novembro de 2007). «Idiopathic pulmonary fibrosis: multiple causes and multiple mechanisms?». The European Respiratory Journal. 30 (5): 835–839. PMID 17978154. doi:10.1183/09031936.00069307
- ↑ Pardo A, Selman M (2002). «Idiopathic pulmonary fibrosis: new insights in its pathogenesis». The International Journal of Biochemistry & Cell Biology. 34 (12): 1534–1538. PMID 12379275. doi:10.1016/s1357-2725(02)00091-2
- ↑ Selman M, King TE, Pardo A (2001). «Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy». Annals of Internal Medicine. 134 (2): 136–151. PMID 11177318. doi:10.7326/0003-4819-134-2-200101160-00015
- ↑ a b «OMIM Entry – # 178500 – PULMONARY FIBROSIS, IDIOPATHIC; IPF». Omim.org. Consultado em 7 de junho de 2018
- ↑ Mathai S, et al. (2014). «Genetic susceptibility and pulmonary fibrosis». Current Opinion in Pulmonary Medicine. 20 (5): 429–435. PMC 4337021
 . PMID 25022318. doi:10.1097/MCP.0000000000000074
. PMID 25022318. doi:10.1097/MCP.0000000000000074
- ↑ Kropski JA, Mitchell DB, Markin C, et al. (6 de fevereiro de 2014). «A novel dyskerin (DKC1) mutation is associated with familial interstitial pneumonia». Chest. 146 (1): e1–7. PMC 4077414
 . PMID 24504062. doi:10.1378/chest.13-2224
. PMID 24504062. doi:10.1378/chest.13-2224
- ↑ Flaherty KR, King TE, Raghu G, Lynch JP, Colby TV, Travis WD, Gross BH, Kazerooni EA, et al. (2004). «Idiopathic interstitial pneumonia: what is the effect of a multidisciplinary approach to diagnosis?». American Journal of Respiratory and Critical Care Medicine. 170 (8): 904–910. PMID 15256390. doi:10.1164/rccm.200402-147OC
- ↑ Flaherty KR, Andrei AC, King TE Jr, Raghu G, Colby TV, Wells A, Bassily N, Brown K, et al. (2007). «Idiopathic interstitial pneumonia: do community and academic physicians agree on diagnosis?». American Journal of Respiratory and Critical Care Medicine. 175 (10): 1054–1060. PMC 1899268
 . PMID 17255566. doi:10.1164/rccm.200606-833OC
. PMID 17255566. doi:10.1164/rccm.200606-833OC
- ↑ Lynch DA, Sverzellati N, Travis WD, Brown KK, Colby TV, Galvin JR, et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. Lancet Respir Med. 2018;6:138–53
- ↑ Taiki Furukawa et al. A comprehensible machine learning tool to differentially diagnose idiopathic pulmonary fibrosis from other chronic interstitial lung diseases. Respirology, 27(9) pp.739-746. Publicado em: 13 de junho 2022 https://doi.org/10.1111/resp.14310
- ↑ Ohshimo S, Bonella F, Cui A, Beume M, Kohno N, Guzman J, Costabel U (2009). «Significance of bronchoalveolar lavage for the diagnosis of idiopathic pulmonary fibrosis». American Journal of Respiratory and Critical Care Medicine. 179 (11): 1043–1047. PMID 19246718. doi:10.1164/rccm.200808-1313oc
- ↑ Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, Coates A, van der Grinten CP, et al. (2005). «Interpretative strategies for lung function tests». European Respiratory Journal. 26 (5): 948–968. PMID 16264058. doi:10.1183/09031936.05.00035205

- ↑ a b Noble PW, Albera C, Bradford WZ, Costabel U, Glassberg MK, Kardatzke D, King TE, Lancaster L, et al. (2011). «Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials». The Lancet. 377 (9779): 1760–1769. PMID 21571362. doi:10.1016/S0140-6736(11)60405-4
- ↑ Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE, Flaherty KR, Schwartz DA, Noble PW, Raghu G, Brown KK (junho de 2005). «The clinical course of patients with idiopathic pulmonary fibrosis». Annals of Internal Medicine. 142 (12 Pt 1): 963–7. PMID 15968010. doi:10.7326/0003-4819-142-12_part_1-200506210-00005
- ↑ a b c King TE, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. (maio de 2014). «A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis» (PDF). New England Journal of Medicine. 370 (22): 2083–92. PMID 24836312. doi:10.1056/NEJMoa1402582
- ↑ a b Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. (maio de 2014). «Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis» (PDF). New England Journal of Medicine. 370 (22): 2071–82. PMID 24836310. doi:10.1056/NEJMoa1402584. hdl:11365/974374

- ↑ Lee JS, McLaughlin S, Collard HR (2011). «Comprehensive care of the patient with idiopathic pulmonary fibrosis». Current Opinion in Pulmonary Medicine. 17 (5): 348–354. PMID 21760508. doi:10.1097/mcp.0b013e328349721b
- ↑ Morrison DA, Stovall JR (1992). «Increased exercise capacity in hypoxemic patients after long-term oxygen therapy». Chest. 102 (2): 542–550. PMID 1643945. doi:10.1378/chest.102.2.542
- ↑ a b c Spagnolo P, Tonelli R, Cocconcelli E, Stefani A, Richeldi L (2012). «Idiopathic pulmonary fibrosis: diagnostic pitfalls and therapeutic challenges». Multidisciplinary Respiratory Medicine. 7 (1): 42. PMC 3537555
 . PMID 23146172. doi:10.1186/2049-6958-7-42
. PMID 23146172. doi:10.1186/2049-6958-7-42
- ↑ Lee JS, McLaughlin S, Collard HR (setembro de 2011). «Comprehensive care of the patient with idiopathic pulmonary fibrosis». Current Opinion in Pulmonary Medicine. 17 (5): 348–54. PMID 21760508. doi:10.1097/mcp.0b013e328349721b
- ↑ Kenn K, Gloeckl R, Behr J (2013). «Pulmonary rehabilitation in patients with idiopathic pulmonary fibrosis—a review». Respiration; International Review of Thoracic Diseases. 86 (2): 89–99. PMID 23942353. doi:10.1159/000354112

- ↑ King TE, Albera C, Bradford WZ, Costabel U, Hormel P, Lancaster L, et al. (julho de 2009). «Effect of interferon gamma-1b on survival in patients with idiopathic pulmonary fibrosis (INSPIRE): a multicentre, randomised, placebo-controlled trial». Lancet. 374 (9685): 222–8. PMID 19570573. doi:10.1016/S0140-6736(09)60551-1. hdl:1942/31878
- ↑ King TE, Brown KK, Raghu G, du Bois RM, Lynch DA, Martinez F, et al. (julho de 2011). «BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmonary fibrosis» (PDF). American Journal of Respiratory and Critical Care Medicine. 184 (1): 92–9. PMID 21474646. doi:10.1164/rccm.201011-1874OC
- ↑ Raghu G, Behr J, Brown KK, Egan JJ, Kawut SM, Flaherty KR, et al. (maio de 2013). «Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial». Annals of Internal Medicine. 158 (9): 641–9. PMID 23648946. doi:10.7326/0003-4819-158-9-201305070-00003
- ↑ Noth I, Anstrom KJ, Calvert SB, de Andrade J, Flaherty KR, Glazer C, et al. (julho de 2012). «A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis». American Journal of Respiratory and Critical Care Medicine. 186 (1): 88–95. PMC 3400994
 . PMID 22561965. doi:10.1164/rccm.201202-0314OC
. PMID 22561965. doi:10.1164/rccm.201202-0314OC
- ↑ Spagnolo P, Del Giovane C, Luppi F, Cerri S, Balduzzi S, Walters EH, D'Amico R, Richeldi L (2010). «Non-steroid agents for idiopathic pulmonary fibrosis». Cochrane Database of Systematic Reviews (9): CD003134. PMID 20824834. doi:10.1002/14651858.CD003134.pub2. hdl:11380/680648

- ↑ Demedts M, Behr J, Buhl R, Costabel U, Dekhuijzen R, Jansen HM, MacNee W, Thomeer M, et al. (2005). «High-dose acetylcysteine in idiopathic pulmonary fibrosis» (PDF). New England Journal of Medicine. 353 (21): 2229–2242. PMID 16306520. doi:10.1056/NEJMoa042976. hdl:2066/47718
- ↑ Raghu G, Anstrom KJ, King TE, Lasky JA, Martinez FJ (maio de 2012). «Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis». New England Journal of Medicine. 366 (21): 1968–77. PMC 3422642
 . PMID 22607134. doi:10.1056/NEJMoa1113354
. PMID 22607134. doi:10.1056/NEJMoa1113354
- ↑ «Commonly used three-drug regimen for idiopathic pulmonary fibrosis found harmful». NIH. 21 de outubro de 2011. Consultado em 11 de abril de 2013
- ↑ The Idiopathic Pulmonary Fibrosis Clinical Research Network. (2014). «Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis». New England Journal of Medicine. 370 (22): 2093–2102. PMC 4116664
 . PMID 24836309. doi:10.1056/nejmoa1401739
. PMID 24836309. doi:10.1056/nejmoa1401739
- ↑ «BIBF 1120 Fact Sheet» (PDF). Dl.groovygecko.net. Consultado em 8 de abril de 2014. Cópia arquivada (PDF) em 3 de março de 2016
- ↑ «FDA Approval Package for Nintedanib» (PDF). www.accessdata.fda.gov. Consultado em 7 de janeiro de 2019
- ↑ «Ofev | European Medicines Agency». www.ema.europa.eu. 17 de setembro de 2018. Consultado em 7 de janeiro de 2019
- ↑ Russo MJ, Iribarne A, Hong KN, Davies RR, Xydas S, Takayama H, Ibrahimiye A, Gelijns AC, Bacchetta MD, D'Ovidio F, Arcasoy S, Sonett JR (2010). «High lung allocation score is associated with increased morbidity and mortality following transplantation». Chest. 137 (3): 651–657. PMC 2832864
 . PMID 19820072. doi:10.1378/chest.09-0319
. PMID 19820072. doi:10.1378/chest.09-0319
- ↑ George TJ, Arnaoutakis GJ, Shah AS (2007). «Lung transplantation for idiopathic pulmonary fibrosis». The Annals of Thoracic Surgery. 84 (4): 1121–1128. PMID 17888957. doi:10.1016/j.athoracsur.2007.04.096
- ↑ Mason DP, Brizzio ME, Alster JM, McNeill AM, Murthy SC, Budev MM, Mehta AC, Minai OA, et al. (2011). «Lung transplant in idiopathic pulmonary fibrosis». Archives of Surgery. 146 (10): 1204–1209. PMID 22006881. doi:10.1001/archsurg.2011.239

- ↑ Keating D, Levvey B, Kotsimbos T, Whitford H, Westall G, Williams T, Snell G (2009). «Lung transplantation in pulmonary fibrosis challenging early outcomes counter balanced by surprisingly good outcomes beyond 15 years». Transplantation Proceedings. 41 (1): 289–291. PMID 19249537. doi:10.1016/j.transproceed.2008.10.042
- ↑ Ryerson CJ, Berkeley J, Carrieri-Kohlman VL, Pantilat SZ, Landefeld CS, Collard HR (2011). «Depression and functional status are strongly associated with dyspnea in interstitial lung disease» (PDF). Chest. 139 (3): 609–616. PMID 20688924. doi:10.1378/chest.10-0608. Cópia arquivada (PDF) em 1 de agosto de 2020
- ↑ Allen S, Raut S, Woollard J, Vassallo M (2005). «Low dose diamorphine reduces breathlessness without causing a fall in oxygen saturation in elderly patients with end-stage idiopathic pulmonary fibrosis». Palliative Medicine. 19 (2): 128–130. PMID 15810751. doi:10.1191/0269216305pm998oa
- ↑ JafariNezhad A, YektaKooshali MH (16 de agosto de 2018). Roviello G, ed. «Lung cancer in idiopathic pulmonary fibrosis: A systematic review and meta-analysis». PLOS ONE. 13 (8): e0202360. Bibcode:2018PLoSO..1302360J. PMC 6095562
 . PMID 30114238. doi:10.1371/journal.pone.0202360
. PMID 30114238. doi:10.1371/journal.pone.0202360
- ↑ a b Agarwal R, Jindal SK (2008). «Acute exacerbation of idiopathic pulmonary fibrosis: a systematic review». European Journal of Internal Medicine. 19 (4): 227–235. PMID 18471669. doi:10.1016/j.ejim.2007.04.024
- ↑ Stern JB, Mal H, Groussard O, Brugière O, Marceau A, Jebrak G, Fournier M (2001). «Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure». Chest. 120 (1): 213–219. PMID 11451841. doi:10.1378/chest.120.1.213
- ↑ a b c Bjoraker JA, Ryu JH, Edwin MK, Myers JL, Tazelaar HD, Schroeder DR, Offord KP (1998). «Prognostic significance of histopathologic subsets in idiopathic pulmonary fibrosis» (PDF). American Journal of Respiratory and Critical Care Medicine. 157 (1): 199–203. PMID 9445300. doi:10.1164/ajrccm.157.1.9704130. Cópia arquivada (PDF) em 27 de fevereiro de 2019
- ↑ a b c Kim DS, Collard HR, King TE (junho de 2006). «Classification and natural history of the idiopathic interstitial pneumonias». Proceedings of the American Thoracic Society. 3 (4): 285–92. PMC 2658683
 . PMID 16738191. doi:10.1513/pats.200601-005TK
. PMID 16738191. doi:10.1513/pats.200601-005TK
- ↑ a b Ley B, Ryerson CJ, Vittinghoff E, Ryu JH, Tomassetti S, Lee JS, Poletti V, Buccioli M, Elicker BM, Jones KD, King TE Jr, Collard HR (2012). «A multidimensional index and staging system for idiopathic pulmonary fibrosis». Annals of Internal Medicine. 156 (10): 684–691. CiteSeerX 10.1.1.691.4472
 . PMID 22586007. doi:10.7326/0003-4819-156-10-201205150-00004
. PMID 22586007. doi:10.7326/0003-4819-156-10-201205150-00004
- ↑ Ryerson CJ, Vittinghoff E, Ley B, Lee JS, Mooney JJ, Jones KD, Elicker BM, Wolters PJ, et al. (2014). «Predicting Survival Across Chronic Interstitial Lung Disease: The ILD-GAP Model». Chest. 145 (4): 723–728. PMID 24114524. doi:10.1378/chest.13-1474
- ↑ King TE, Albera C, Bradford WZ, Costabel U, du Bois RM, Leff JA, Nathan SD, Sahn SA, Valeyre D, Noble PW (abril de 2014). «All-cause mortality rate in patients with idiopathic pulmonary fibrosis. Implications for the design and execution of clinical trials». American Journal of Respiratory and Critical Care Medicine. 189 (7): 825–31. PMID 24476390. doi:10.1164/rccm.201311-1951OC. hdl:2318/156709

- ↑ Peljto AL, Zhang Y, Fingerlin TE, Ma SF, Garcia JG, Richards TJ, Silveira LJ, Lindell KO, et al. (2013). «Association between the MUC5B promoter polymorphism and survival in patients with idiopathic pulmonary fibrosis». JAMA. 309 (21): 2232–2239. PMC 4545271
 . PMID 23695349. doi:10.1001/jama.2013.5827
. PMID 23695349. doi:10.1001/jama.2013.5827
- ↑ Stock CJ, Sato H, Fonseca C, Banya WA, Molyneaux PL, Adamali H, Russell AM, Denton CP, et al. (2013). «Mucin 5B promoter polymorphism is associated with idiopathic pulmonary fibrosis but not with development of lung fibrosis in systemic sclerosis or sarcoidosis». Thorax. 68 (5): 436–441. PMID 23321605. doi:10.1136/thoraxjnl-2012-201786

- ↑ a b Pulmonary Fibrosis Foundation. "Prevalence and Incidence". Pulmonaryfibrosis.org. Retrieved 11 April 2013
- ↑ Gribbin J, Hubbard RB, Le Jeune I, Smith CJ, West J, Tata LJ (2006). «Incidence and mortality of idiopathic pulmonary fibrosis and sarcoidosis in the UK». Thorax. 61 (11): 980–985. PMC 2121155
 . PMID 16844727. doi:10.1136/thx.2006.062836
. PMID 16844727. doi:10.1136/thx.2006.062836
- ↑ «Eurostat News Release. European demography. 110/2010. 27 July 2010» (PDF). Epp.eurostat.ec.europa.eu. Consultado em 7 de junho de 2018
- ↑ Hyldgaard C, Hilberg O, Muller A, Bendstrup E (2014). «A cohort study of interstitial lung diseases in central Denmark». Respiratory Medicine. 108 (5): 793–799. PMID 24636811. doi:10.1016/j.rmed.2013.09.002

- ↑ Williams K, Malarkey D, Cohn L, Patrick D, Dye J, Toews G (2004). «Identification of spontaneous feline idiopathic pulmonary fibrosis: morphology and ultrastructural evidence for a type II pneumocyte defect». Chest. 125 (6): 2278–2288. PMID 15189952. doi:10.1378/chest.125.6.2278
- ↑ Webb JA, Armstrong J (2002). «Chronic idiopathic pulmonary fibrosis in a West Highland white terrier». The Canadian Veterinary Journal. 43 (9): 703–705. PMC 339552
 . PMID 12240528
. PMID 12240528
- ↑ «AKC Canine Health Foundation». Akcchf.org. Consultado em 7 de junho de 2018
- ↑ «Active Clinical Trials and Investigational Research in IPF». Consultado em 4 de setembro de 2014. Cópia arquivada em 4 de setembro de 2014
- ↑ «Research Demonstrates Reversal Of Pulmonary Fibrosis With miRagen Therapeutics Synthetic microRNA-29 Mimic (promiR-29)». Pulmonaryfibrosisnews.com. 23 de setembro de 2014. Consultado em 8 de junho de 2018
- ↑ Liu M, Ren D, Wu D, Zheng J, Tu W (2015). «Stem Cell and Idiopathic Pulmonary Fibrosis: Mechanisms and Treatment». Current Stem Cell Research & Therapy. 10 (6): 466–76. PMID 25986617. doi:10.2174/1574888X10666150519092639
- ↑ «Stem cell therapy for lung fibrosis conditions». Sciencedaily.com. Consultado em 8 de junho de 2018
- ↑ Onishchenko D, Marlowe RJ, Ngufor, Faust LJ, Limper AH, Hunninghake GM, Martinez FJ, Chattopadhyay I (2022). «Screening for idiopathic pulmonary fibrosis using comorbidity signatures in electronic health records.». Nature Medicine. 28 (10): 2107–2116. PMID 36175678. doi:10.1038/s41591-022-02010-y



